MEDICAL PRODUCT DEVELOPMENT
MDR 2017/745/EU – CE-ISO 9241-210 / IEN 62366 / ISO 9001
PLAYING BY THE RULES
Sich an die Regeln halten ist entscheidend für ein erfolgreiches Medizinprodukt. Aber auch zu wissen wie man diese Regeln umsetzen und an ihre Grenzen ausschöpfen kann, macht den Unterschied. Unser Multidizipläry Team bei Entwurfreich kennt diese Normen und Gesetze und führ Sie so durch die komplexe, regulatorischen umgebung in Helatcare Sektor.
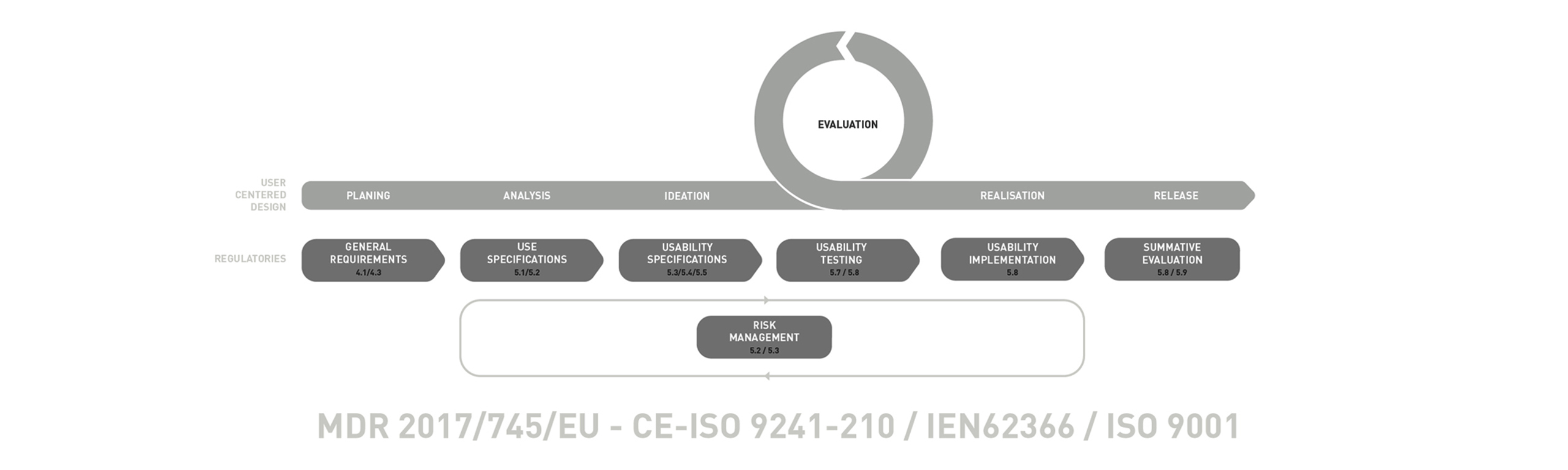
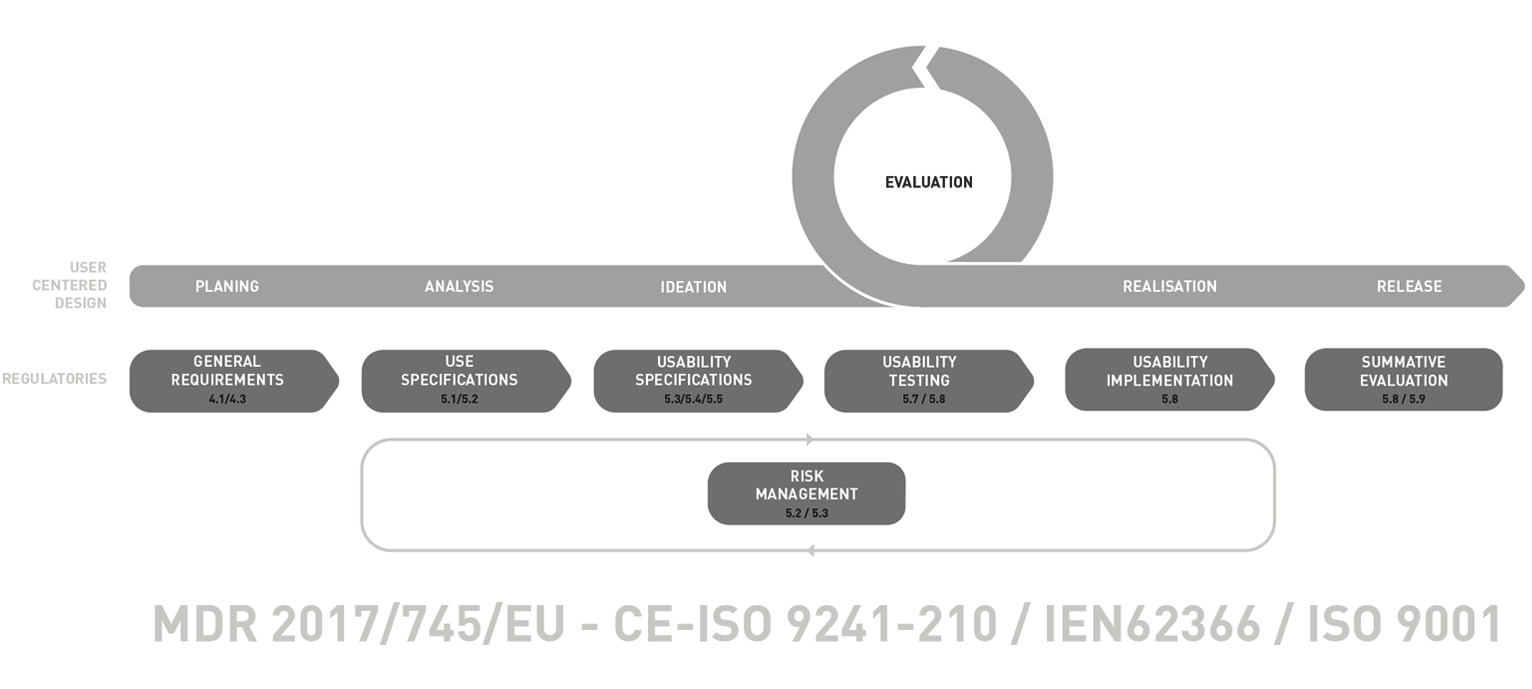
Unser User Centered Design Prozess für Medizinprodukte ist angelehnt an die EIN60223 und ergänzt sie durch in der Praxis bewährte Meilensteine und Methoden. Dies garantiert einen gebrauchstauglichkeitsorientierten Entwicklungsprozess, welcher Kosteneffitiens und On-Time delivery garantiert.

Start with ENTWURFREICH
Our Process

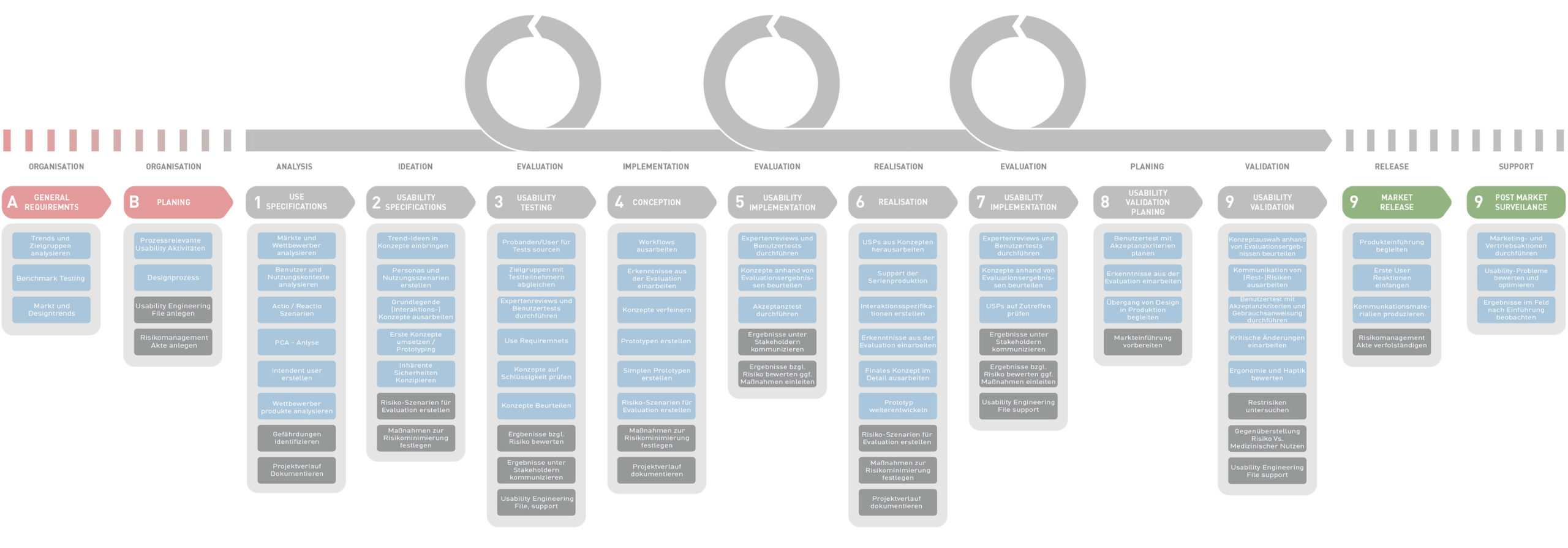
General Requirements
Planning
Die Planung hat einen wichtigen Stellenwert und wird von unserem gesamten Team sorgsam durchgeführt. Hier werden neben den Trend- und Designanalysen die erste Usability Aktivitäten für den gesamten Prozess geplant.
Use Specifications
Analysis
Zuerst wird der Nutzungskontext analysiert und Nutzer und Nutzungsgruppen, (Intendent user) erfasst. Durch verschiedene Analysemöglichkeiten, z.B. PCA-Analyse können bereits Potenzielle Interaktionsprobleme ermittelt werden. Parallel werden die Märkte und Wettbewerber durchleuchtet, um dieses Wissen bereits in eine Neuentwicklung einfließen zu lassen.

Usability Specifications
Ideation
In diesem Schritt werden Nutzungsszenarien erstellt und erste grundlegende potentiale für die Konzeption entwickelt. Ziel ist es mögliche Use Errors zu entdecken und durch die Erarbeitung Inhärenter Sicherheiten, bereits frühzeitig vorzubeugen.
Usability Testing
Evaluation
Durch frühzeitige und iterative Testreihen auf einem formativen Level, können erste Ergebnisse kostengünstig getestet werden. Mögliche Probleme könne so frühzeitig entdeckt werden und tragen so zu einer wesentlichen Risikominimierung bei, indem diese bereits während der Entwicklung reduziert werden.


Usability Implementation
Realisation
Die aus den Konzepten erarbeiteten USPs werden herausgearbeitet und Interaktionsspezifikationen werden erstellt. Mögliche Prototypen werden weiterentwickelt und die Serienproduktion vorbereitet. Maßnahmen zur Riskominimierung werden festgelegt.
Summative Evaluation
Release
Hier erfolgt die „Endkontrolle“ der Qualitätssicherung. Die Konzepte werden anhand von Evaluationsergebnissen beurteilt und Akzeptanztests durchgeführt. Die Prototypen sind Seriennah ausgearbeitet und müssen die Akzeptanzkriterien erfüllen.


Risk Management
Documentation
Das Risiko Management ist systematisch in allen unseren Arbeitsschritten enthalten. Ziel ist es Risiken bereits während der Entwicklung zu reduzieren. Durch „Risk Control Measures“ werden Use-Errors Frühzeit erkannt und durch vorbeugende Maßnahmen abgeschätzt, bewertet und kontrolliert. Unsere Ergebnisse können direkt in die Risikomanagementakte eingearbeitet und dokumentiert werden.
Our Detailed Process
Start with ENTWURFREICH

Nicht nur regulativ durchdachte Ergebnisse
Wir erarbeiten Designs ganzheitlich aus der Sicht der Zielgruppe, der Gebrauchstauglichkeit und den diversen Herstellungsmöglichkeiten. Unsere Erfahrung und unser Wissen ermöglicht es uns Produkte nicht nur Regulatorisch korrekt zu erarbeiten, sondern auch ästhetisch ansprechen und innovativ zu gestalten. In unserer Designentwicklung setzen wir Trends frühzeitig um,
prägen die Markenwahrnehmung und schaffen Begehrlichkeiten, die sich von der Konkurrenz absetzen. Unser Multidisziplinäre Team kombiniert Kreativität, Innovation und Usability mit dem Augenmerk auf Produktionsspezifikationen und Kosten. Dies garantiert schon in frühen Phasen unsere Entwicklung ein produzierbares Medizinprodukt.
Related Work
How we improve the world.










